Stressfaktoren wie Temperatur, pH-Wert oder Druck beeinträchtigen die Hefevitalität [1]. Für den Brauer bedeutet Hefe mit schlechter Vitalität eine Reihe von Problemen: verzögerte Angärung, verlangsamter Extraktabbau oder veränderte Bildung von Aromastoffen [2,3]. Eine gute Hefevitalität liegt also im Interesse des Brauers. Marco Eigenfeld untersucht in diesem Beitrag, wie sich die Stressfaktoren osmotischer Druck, Nährstoffmangel und Hefeführung auf die Morphologie, den intrazellulären pH-Wert (ICP) und die Fluidität der Hefezelle auswirken.
Äußere und innere Stressfaktoren
Hefezellen sind äußeren (exogenen) und inneren (endogenen) Stressfaktoren ausgesetzt. Eine Reihe von äußeren Stressfaktoren, die auf die Hefezelle einwirken, sind in Abb. 1 aufgeführt. Ein Beispiel für einen inneren Stressfaktor ist beispielsweise die Menge an oxidierten oder falsch gefalteten Proteinen [2].
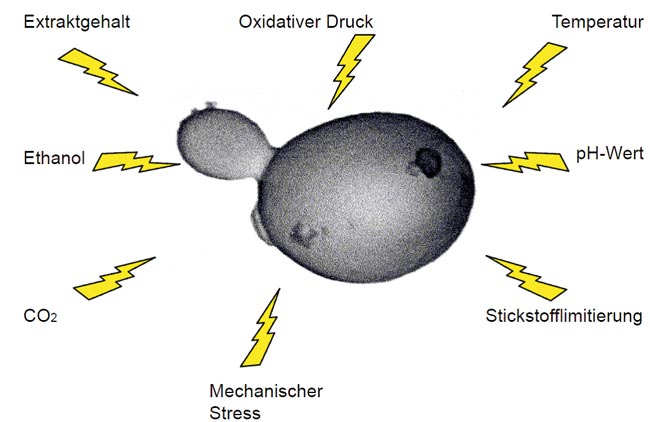
Hefevitalität und intrazellulärer pH-Wert
Die Bewertung der Hefevitalität erfolgt meist über die Messung des intrazellulären pH-Wertes (ICP) mittels Durchflusszytometrie. Ein ICP von > pH 6,0 bedeutet eine sehr gute Hefevitalität, Werte von < 5,6 eine schlechte Hefevitalität. Ein niedriger ICP hemmt unter anderem die Schlüsselenzyme der Glycolyse und Glyconeogenese im Inneren der Hefezelle. Diese arbeiten bei niedrigen pH-Werten nicht im optimalen Bereich.
Hoher ICP = effizienter Nährstofftransport
Protonenpumpen in der Plasmamembran regulieren den ICP. Sie transportieren Wasserstoffionen aus dem Cytosol in den extrazellulären Raum [4]. Dadurch erhöht sich der ICP und es entsteht ein Protonengradient über die Plasmamembran. Dieser Protonengradient ermöglicht im Gegenzug einen Nährstofftransport in die Hefezelle über andere Transportkanäle der Zellmembran [5]. Ein hoher Protonengradient (und damit ein hoher intrazellulärer pH-Wert) erleichtert also den Nährstoffimport, die Hefe ist vital und zeichnet sich durch positive Fermentationseigenschaften aus.
Membranfluidität und Aktivität der Protonenpumpen
Wie erwähnt, erfolgt also die Regulation des pH-Wertes im Zellinneren durch die Aktivität der Protonenpumpen der Plasmamembran. Weiterhin hängen die Eigenschaften der Plasmamembran stark von den Umgebungsbedingungen ab: Es besteht ein direkter Zusammenhang zwischen der Aktivität der Protonenpumpen (und damit dem ICP) und der Beschaffenheit der Hefeplasmamembran, insbesondere der Membranfluidität.
Messung der Membranfluidität mittels Fluoreszenzanisotropie
Mit der Fluoreszentanisotropie erfasst man direkt die Beschaffenheit der Plasmamembran: fluide oder rigide. Linear polarisiertes Licht regt bei diesem Messverfahren sogenannte Fluophore, also fluoreszierende Substanzen, an.
Befinden sich die Fluorophore in einer Umgebung mit niedrigerer Viskosität (fluide Plasmamembran), emittieren sie verstärkt depolarisiertes Licht, der Zahlenwert der Anisotropie ist dann niedriger.
In einer Umgebung höherer Viskosität (rigide Plasmamembran) emittieren sie verstärkt polarisiertes Licht, der Zahlenwert der Anisotropie ist dann größer.
Insofern gibt die Methode direkte Hinweise auf die Fluidität bzw. Rigidität der Plasmamembran und damit deren Zustand.
Der Gehalt an Sterolen beeinflusst die Membranfluidität
Abb. 2 zeigt schematisch den Aufbau einer Plasmamembran. Die Hauptfunktionen der Membran sind die Kontrolle der osmotischen Stabilität, der Zellwand-Biosynthese, der selektiven Durchlässigkeit von Komponenten, welche die Zelle verlassen, sowie der Protonenpumpe [6,7]. Die Membran setzt sich aus einer Phospholipiddoppelschicht zusammen, welche reich an Sterolen ist [8,9]. Aufgrund der sterischen Hinderung durch die Sterole wirkt sich deren Gehalt direkt auf die Membranfluidität aus: Mit steigender Konzentration an Sterolen nimmt die Rigidität zu.
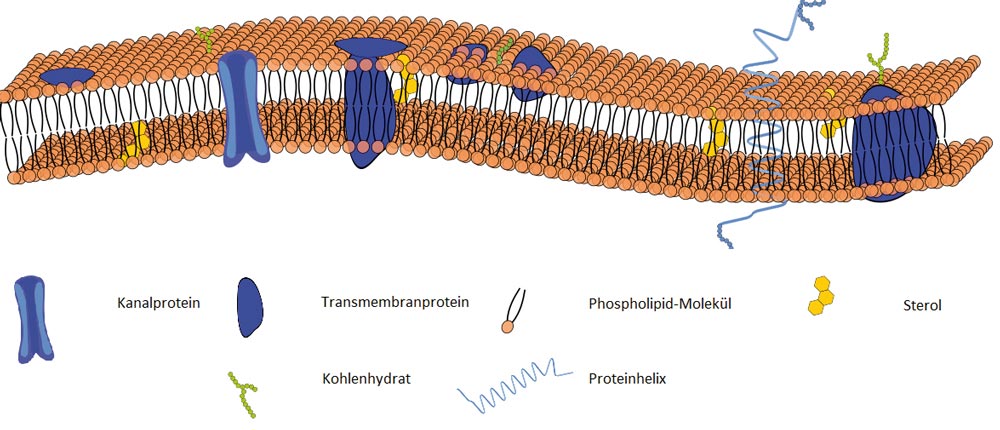
Die Membranfluidität, gemessen über die Anisotropie, beschreibt somit die Beweglichkeit der Phospholipide innerhalb der Membran und wird im nachfolgend beschriebenen Versuch als neuer Ansatz zur Beurteilung des physiologischen Zustandes der Hefezellpopulation unter Stresseinfluss untersucht.
Versuchsdurchführung
Zur Betrachtung des Einflusses von Stress auf die Hefevitalität wurde die untergärige Reinzuchthefe TUM 34/70 zunächst einzelnen Stressfaktoren ausgesetzt:
- Osmotischem Druck durch Zugabe von Sorbitol;
- Nährstoffentzug durch Überführung in destilliertes Wasser;
- Industrieller Stressor (Anzahl der Führungen) anhand einer Erntehefe der 5. Führung;
- Referenz: Reinzuchthefe.
Von allen Proben wurden mikroskopische Aufnahmen, wie auch eine ICP- und Fluoreszenzanisotropie-Messung durchgeführt.
Elektronenmikroskop: Hefemorphologie unter Stress
Die Reinzuchthefe (Abb. 3, links) weist eine charakteristische ovale Form mit einer glatten Oberfläche auf, die Sprossnarben sind gut erkennbar. Die Erntehefe (Abb. 3, rechts) weist im Vergleich dazu eine fast runde Zellform mit Einstülpung auf. Diese untypische Zellform ist auch bei osmotischem Druck (Abb. 4, links) und Nährstoffentzug (Abb. 4, rechts) zu sehen. Die Stressfaktoren führen zum Kollabieren der Zellwand. Die Zellen zeigen leicht raue Zelloberflächen und eine faltige Struktur. Bei osmotischem Stress und bei Nährstoffentzug sind keine Sprossnarben erkennbar, die Zellen kommen verstärkt in Agglomeraten vor.
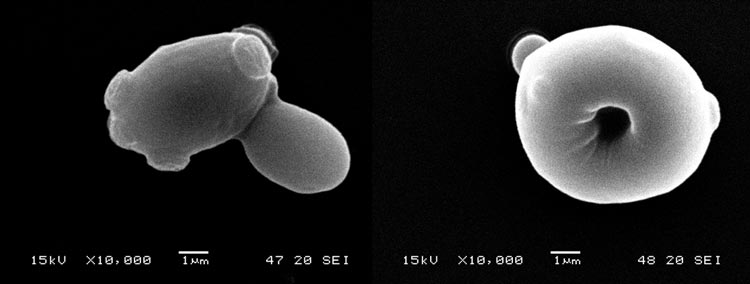
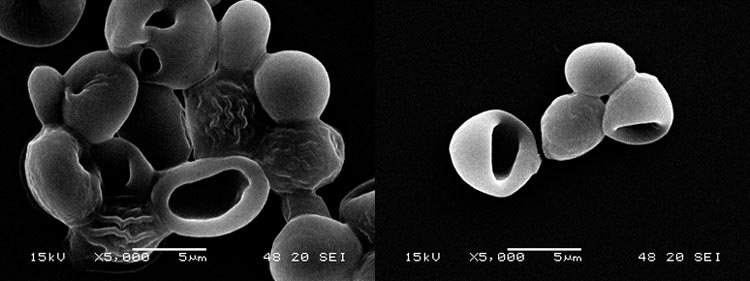
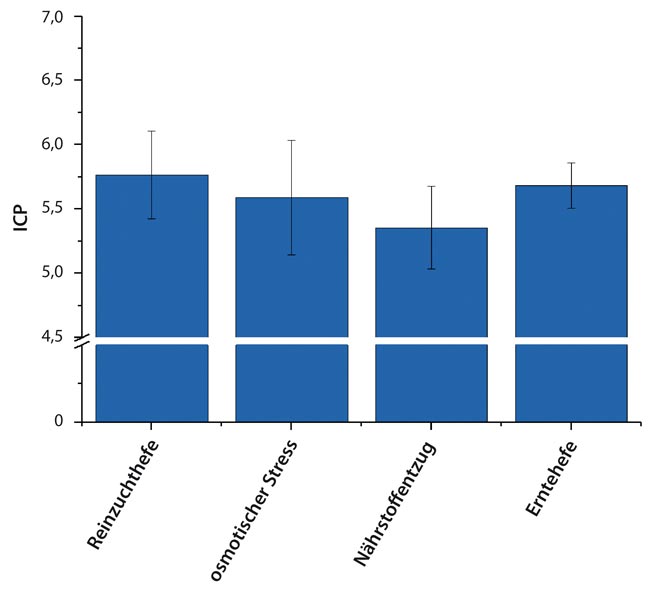
Vergleich: ICP und Fluoreszenzanisotropie
Die gemessenen ICP-Werte (Abb. 5) von Reinzuchthefe: 5,76, osmotischer Stress: 5,59, Nährstoffentzug: 5,35 und Erntehefe: 5,68 lassen insgesamt keine signifikanten Unterschiede erkennen. Die beiden singulären Stressoren osmotischer Stress und Nährstoffentzug beeinflussen den ICP zwar am stärksten negativ, die Mittelwerte liegen aber allesamt innerhalb der Messfehler.
Die Betrachtung der Fluoreszenzanisotropie hingegen zeigt eine deutlichere Veränderung innerhalb der untersuchten Proben (Abb. 6). Vergleichend zur Reinzuchthefe weisen die beiden singulären Stressoren osmotischer Stress und Nährstoffentzug signifikant höhere Anisotropie-Werte auf, was einer rigideren Membran entspricht. Hingegen weist die Erntehefe im direkten Vergleich zur Reinzuchthefe mit signifikant niedrigeren Werten der Anisotropie eine fluidere Membran auf.
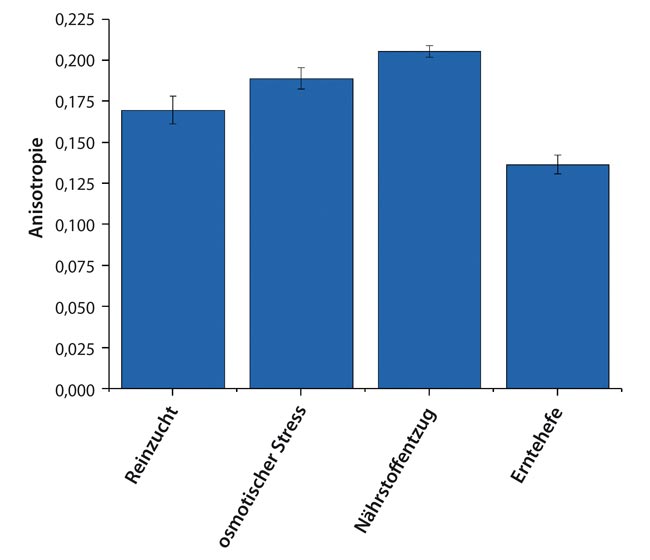
Interpretation: bislang nur eingeschränkt
Obwohl ähnliche Beobachtungen auch von anderen Forschergruppen berichtet wurden [10], ist die Interpretation der Ergebnisse bislang nur eingeschränkt möglich. Eine rigide Membran stellt grundsätzlich einen Nachteil für die Hefezelle dar, weil Nährstoffe nur eingeschränkt ins Zellinnere transportiert werden.
Andererseits: Eine fluidere Membran lässt zwar einen höheren Nährstofffluss zu, ist dafür aber auch für toxische Stoffe wie beispielsweise Ethanol durchlässiger [10, 11], weshalb auch hier aktuell keine Bewertung erfolgen kann.
Zusammenfassung
- Stresseinflüsse wirken sich sowohl auf die Morphologie der Hefezellen als auch auf den ICP-Wert und die Fluoreszenzanisotropie aus;
- Die Fluoreszenzanisotropie stellt im Vergleich zur durchflusszytometrischen Bestimmung des intrazellulären pH-Wertes einen sensibleren Messparameter dar, da die ICP-Messung keine signifikanten Unterschiede zwischen den Stressoren erkennen lies;
- In den Versuchen der Fluoreszenzanisotropie zeigte sich, dass unterschiedliche Stressoren signifikante Auswirkung auf die Membranfluidität haben;
- Ob nun eine rigidere oder fluidere Membran von Vorteil ist, kann aber aufgrund fehlender Datensätze derzeit nicht bewertet werden;
- Zukünftige Forschungen werden zeigen, ob die Anisotropie das Potential für die Bewertung der Hefevitalität in den komplexen Fermentationsprozessen der Brauwirtschaft besitzt.
Danksagung
Die Autoren danken Prof. Dr. Sevil Weinkauf der Professur für Elektronenmikroskopie der TU München für die Möglichkeit zur Nutzung des Rasterelektronenmikroskops. Zudem Dr. Beate Rockel für die freundliche Unterstützung und Einweisung in die Gerätschaft.
Literatur
- Lodolo, E.J.; I.C. Cantrell: „Yeast Vitality – A Holistic Approach toward an Integrated Solution to Predict Yeast Performance”, Journal of the American Society of Brewing Chemists, 65(4), 2007, S. 202-207.
- Heggart, H., et al.: „Measurement of brewing yeast viability and vitality: a review of methods”, Technical quarterly – Master Brewers Association of the Americas, 37(4), 2000, S. 409-430.
- Back, W., et al.: Yeast vitality and beer quality, Vol. 51, 1998, S.189-195.
- Bracey, D., et al.: „Determination of the intracellular pH (pHi) of growing cells of Saccharomyces cerevisiae: the effect of reduced-expression of the membrane H+-ATPase”, Journal of Microbiological Methods, 31(3), 1998, S. 113-125.
- Serrano, R.: „Plasma Membrane ATPase of Fungi and Plants as a Novel Type of Proton Pump”, Horecker B.L.; Stadtman, E.R. (Ed.): Current Topics in Cellular Regulation, Academic Press, 1984, S. 87-126.
- van der Rest, M.E., et al.: „The plasma membrane of Saccharomyces cerevisiae: structure, function, and biogenesis”, Microbiological Reviews, 59(2), 1995, S. 304-322.
- Feldmann, H.: Yeast, Wiley-VCH, 2010.
- Anderson, R.G.W.; Jacobson, K.: „A Role for Lipid Shells in Targeting Proteins to Caveolae, Rafts, and Other Lipid Domains”, Science, 296(5574), 2002, S. 1821-1825.
- Frye, L.D.; Edidin, M.: „The Rapid Intermixing of Cell Surface Antigens After Formation of Mouse-Human Heterokaryons”, Journal of Cell Science, 7(2), 1970, S 319-335.
- Aguilera, F., et al.: „Relationship between ethanol tolerance, H+-ATPase activity and the lipid composition of the plasma membrane in different wine yeast strains”, International Journal of Food Microbiology, 110(1), 2006, S. 34-42.
- Anbazhagan, V., et al.: „Fluidizing the Membrane by a Local Anesthetic: Phenylethanol Affects Membrane Protein Oligomerization”, Journal of Molecular Biology, 404(5), 2010, S. 773-777.
 Latest News
Latest News



